PGD
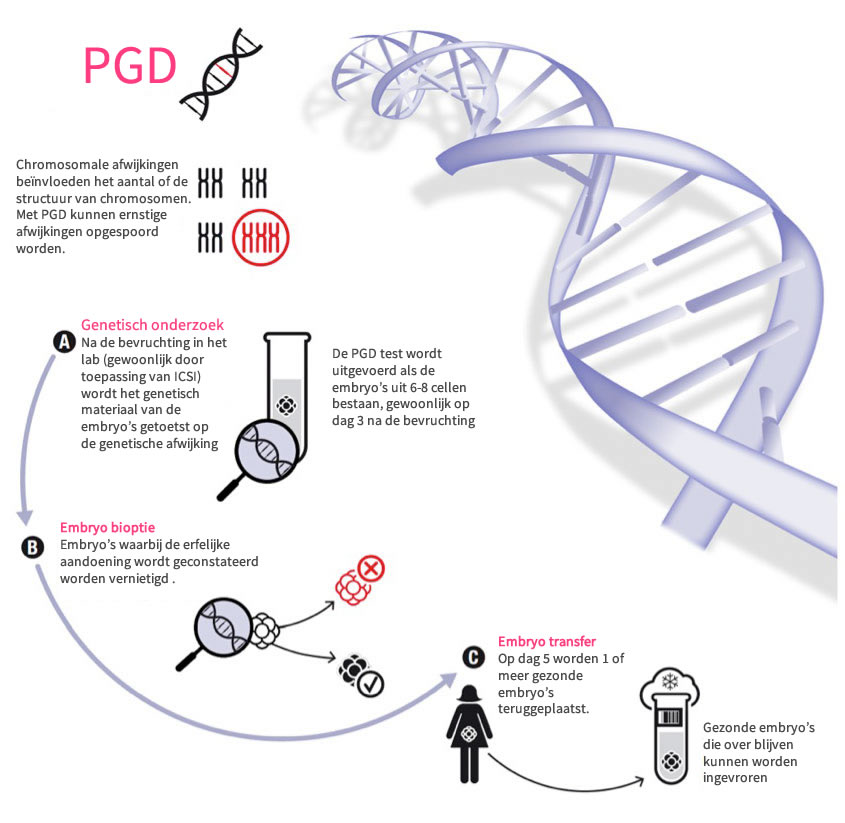
PGD (Pré-Implantatie Genetische Diagnostiek) werd in 1989 in Engeland geïntroduceerd. In Istanbul wordt deze methode sinds 2001 gebruikt. PGD is een methode waarmee het mogelijk is om ernstige erfelijke afwijkingen aan te tonen in embryo's tijdens de vroegste stadia van ontwikkeling. De diagnose vindt plaats drie dagen na de bevruchting van de eicel, wanneer het embryo nog maar uit ongeveer acht cellen bestaat. Het embryo is op dat moment nog te klein om zich in de baarmoederwand in te nestelen (=implanteren), vandaar de term pré-implantatie genetische diagnostiek. Deze vorm van diagnostiek kan slechts worden toegepast na reageerbuisbevruchting (IVF). Ze heeft als groot voordeel dat er een selectie van embryo's met ernstige genetische afwijkingen plaatsvindt voordat er sprake is van een zwangerschap. Wanneer uit de analyse blijkt dat er embryo's zonder de onderzochte afwijking aanwezig zijn, worden er in de regel twee embryo's in de baarmoeder geplaatst. Hieruit kan zich vervolgens een normale zwangerschap ontwikkelen. Bij PGD via Human First geldt geen wachtlijst. Het voortraject is vergelijkbaar met dat van IVF/ICSI en tijdens de hormoonstimulatie fase wordt de eigenlijke test ontwikkeld; de test is normaal gesproken binnen 2 weken klaar om toegepast te worden, precies de duur van het IVF/ICSI traject. Doordat de test wordt uitvoerd op de derde dag van de embryo ontwikkelingsfase, is het verblijf voor stellen die PGD ondergaan geen 17 dagen, maar 20 dagen. Bij PGD worden een of meer embryo's op dag 5 teruggeplaatst.
 Voor wie is PGD bedoeld?
Voor wie is PGD bedoeld?
Tot voor kort was het alleen mogelijk om erfelijke afwijkingen op te sporen tijdens de zwangerschap. De vruchtwaterpunctie en de vlokkentest zijn de meest gangbare vormen van prenatale (letterlijk: voor de geboorte) diagnostiek. De pré-implantatie (letterlijk: vóór de innesteling) genetische diagnostiek is een relatief nieuwe methode.
De PGD is géén onvruchtbaarheidsbehandeling. Ze is uitsluitend bedoeld voor paren bij wie er sprake is van een ernstige erfelijke aandoening met een hoog (herhalings)risico. De IVF is een noodzakelijk onderdeel van de PGD-procedure. Alleen aan de hand van IVF is het mogelijk om gelijktijdig meerdere eicellen tot volledige rijping te laten komen en te bevruchten, zodat de kans op (gezonde) embryo's groter wordt. Paren die in aanmerking willen komen voor PGD dienen dus niet alleen te voldoen aan de voor PGD gestelde voorwaarden, maar moeten tevens geschikte kandidaten zijn voor IVF.
De IVF is een noodzakelijk onderdeel van de PGD-procedure. Alleen op deze wijze is het mogelijk om gelijktijdig meerdere eicellen te laten rijpen en te bevruchten, zodat meerdere embryo’s ontstaan waar de test op kan worden toegepast.
Voor welke aandoeningen?
De meest voorkomende erfelijke aandoeningen waarvoor PGD toegepast is, zijn:
- Ziekte van Huntington
- Erfelijke borst- en eierstokkanker
- Myotone dystrofie type I (ziekte van Steinert)
- Familiaire Adenomateuze Polyposis coli (FAP)
- Marfan syndroom
- Neurofibromatose type I
- Cystische fibrose
- Spinale spieratrofie
- Fragiele X syndroom
- Hemofilie A/B
- Duchenne / spierdystrofie
- Chromosomale afwijkingen (waarbij een van de ouders drager is, zoals een translocatie = een afwijking in de structuur van twee of meer chromosomen)
Verschil prenatale diagnostiek en pré-implantatie genetische diagnostiek
Het verschil tussen beide is dat er bij de prenatale diagnostiek wordt gekeken naar afwijkingen in een reeds bestaande zwangerschap, terwijl bij pré-implantatie genetische diagnostiek de analyse van de embryo's plaatsvindt voordat er sprake is van een eigenlijke zwangerschap.
Hoe verloopt een PGD-behandeling?
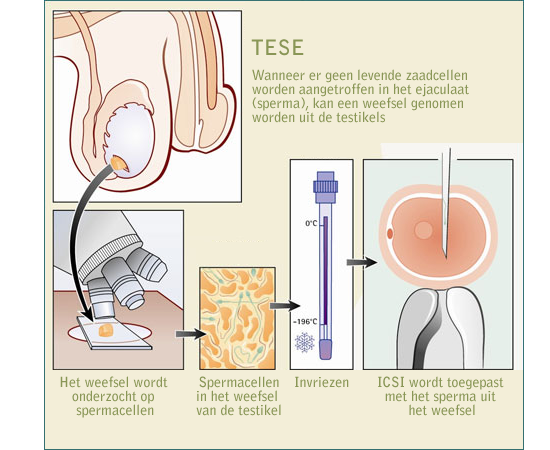
PGD is binnen handbereik van artsen gekomen door wetenschappelijke ontwikkelingen die het mogelijk gemaakt hebben de erfelijke informatie van een individuele cel te onderzoeken. Zo kunnen embryo's met en zonder aandoening van elkaar onderscheiden worden. In grote lijnen verloopt een IVF-behandeling met PGD hetzelfde als een 'gewone' IVF-behandeling. De behandeling bestaat uit stimulatie van de eierstokken door middel van hormonen, een punctie van de eicellen uit de eierstokken en een terugplaatsing van embryo's. Een verschil ten opzichte van een 'gewone' IVF-behandeling is dat de twee of - bij uitzondering - drie embryo's iets later worden overgebracht naar de baarmoeder. Zonder PGD gebeurt dit namelijk op de tweede of de derde dag na de punctie. Bij een PGD-behandeling echter pas op de derde of de vierde dag na de punctie. Wanneer na een punctie een eicel in het laboratorium bevrucht is met zaad van de partner begint de eicel te delen. De eerste deling vindt plaats ongeveer dertig uur na de punctie. Wanneer de eicel gedeeld is spreken we van een embryo. Nadat de eerste deling voltooid is, bestaat het embryo uit twee identieke dochtercellen. Ook deze cellen zullen vervolgens weer gaan delen en zestig tot tweeënzeventig uur na de punctie (dag 3) bestaat het embryo uit ongeveer acht dochtercellen. Dit stadium is de ideale situatie voor de afname van één of twee cellen die nodig zijn voor de analyse van het embryo. De methode verloopt als volgt: met een uiterst dunne naald wordt een kleine opening gemaakt in de schil die het embryo omhult. Met behulp van een iets grotere naald worden daarna één of twee cellen weggezogen (gebiopteerd). De afgenomen cellen worden zodanig behandeld dat de genetische samenstelling ervan onderzocht kan worden. Het genetisch onderzoek voltrekt zich, afhankelijk van de analysemethode, binnen een of twee dagen, zodat de terugplaatsing van 'gezonde' embryo's in de baarmoeder de derde of vierde dag na de punctie kan plaatsvinden.
Bij PGD geen sprake van verminderde vruchtbaarheid
Omdat er bij patiënten met een erfelijke aandoening meestal geen sprake is van verminderde vruchtbaarheid, worden er in de regel twee (op medische gronden geselecteerde) embryo's teruggeplaatst. Een andere reden om slechts twee embryo's terug te plaatsen is dat wanneer er een tweelingzwangerschap zou ontstaan prenatale diagnostiek nog wel mogelijk is, maar dat dit bij een drieling- of vierlingzwangerschap vrijwel onuitvoerbaar is. Bovendien brengen grotere meerlingzwangerschappen extra medische risico's voor moeder en kind met zich mee. Na een terugplaatsing is er echter nog geen garantie op zwangerschap.
Wat zijn de kansen?
De kans op succes (zwangerschap) wordt voornamelijk bepaald door de slagingskans van de IVF-behandeling. De slagingskans van IVF bedraagt bij paren die wegens verminderde vruchtbaarheid worden behandeld ongeveer 20% per gestarte poging. In hoeverre PGD dit slagingspercentage beïnvloedt valt nog moeilijk te bepalen en zal wellicht ook samenhangen met de te onderzoeken aandoening. Naar verwachting zal de kans op succes in diezelfde orde van grootte liggen.
Hoe betrouwbaar is PGD?
Alle PGD analyses die in een klinische setting worden toegepast zijn eerst zeer uitvoerig getest in het laboratorium. De nauwkeurigheid van de bestaande methoden is dan ook groot (98%). De betrouwbaarheid kan echter voor individuele paren hoger of lager liggen. Het wordt aangeraden om bij een doorgaande zwangerschap te kiezen voor prenatale diagnostiek (vlokkentest of vruchtwaterpunctie).
Waar wordt PGD toegepast?
Er zijn wereldwijd ongeveer 50 centra die PGD toepassen. In Nederland wordt PGD momenteel alleen toegepast in het Academisch Ziekenhuis in Maastricht. Hierdoor zijn de wachtlijsten in Nederland voor PGD erg lang, varierend tussen 3 tot 9 maanden voor het ontwikkelen van de test. Daarbij komt de "normale" wachtlijst, zo'n 2 tot 3 maanden voor het intake gesprek en daaropvolgend nog 3 maanden voordat gestart kan worden met IVF/ICSI. Dus in totaal kan hierdoor de wachtlijst oplopen tot 9 tot 15 maanden. Gelukkig ligt dat anders in Turkije; Human First helpt u in de voorbereidende fase met het regelen van vergoeding door uw zorgverzekeraar, het laten uitvoeren van bloedtesten en maakt samen met u een planning voor de uiteindelijke start van de behandeling. Dit neemt een paar weken in beslag. Daarna vliegt u naar Turkije en kunt u direct starten met de ICSI-behandeling waarna aansluitend de PGD test wordt uitgevoerd. In plaats van 17 dagen verblijft u 20 dagen in Turkije. Het ontwikkelen van de PGD test in Memorial Hospital neemt slechts 2 weken in beslag en hiermee wordt de dag na aankomst gelijk gestart.

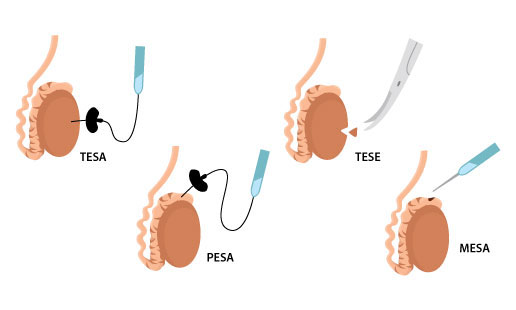
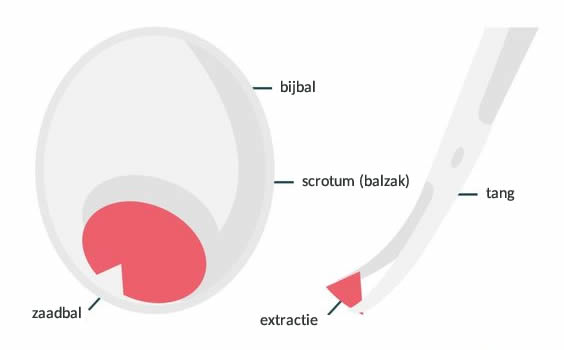 RO-TESE is de chirurgische extractie van zaadcellen direct uit de zaadbal. Deze behandeling wordt voornamelijk toegepast bij mannen waarbij in het sperma geen zaadcellen zijn aangetroffen (azoospermie).
RO-TESE is de chirurgische extractie van zaadcellen direct uit de zaadbal. Deze behandeling wordt voornamelijk toegepast bij mannen waarbij in het sperma geen zaadcellen zijn aangetroffen (azoospermie).