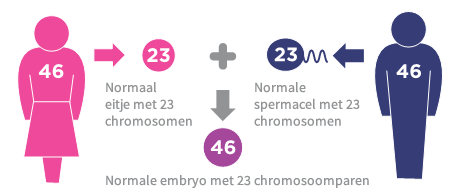
Een lichaam bestaat uit miljarden cellen. In de kern van deze cellen zitten de chromosomen. De chromosomen zijn de dragers van ons erfelijkheidsmateriaal en bevatten genen. Elke lichaamscel heeft gewoonlijk 23 paar chromosomen, waarbij elk paar uit twee dezelfde chromosomen is opgebouwd. In totaal heeft iedere lichaamscel dus 46 chromosomen. In de eicel en zaadcel (voortplantingscellen) zitten ieder 23 chromosomen. Tijdens de bevruchting komen er 23 chromosomen van de eicel van de moeder en 23 chromosomen vanuit de zaadcel van de vader bij elkaar. Zo ontstaat er weer een cel met 46 chromosomen.
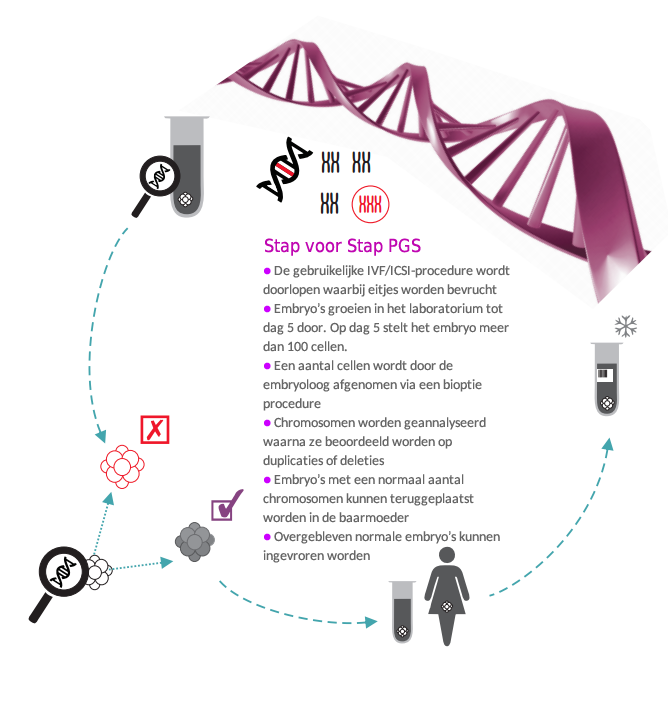
PGS staat voor Preimplantation Genetic Screening. Deze procedure bestaat uit het weghalen van een of meer cellen uit een embryo waarna deze cellen worden gecontroleerd op het aantal chromosomen. Er wordt hiermee gekeken hoeveel chromosomen de embryo's bevatten; zo komen we vooraf te weten welke embryo's over 46 chromosomen (ofwel 23 paar chromosomen) beschikken, of over een abnormaal aantal. Als het aantal chromosomen afwijkt van 46, dan zal dit door de PGS opgemerkt worden. Een normale embryo beschikt over 23 chromosomen van de moeder en 23 chromosomen van de vader. Bij het Syndroom van Down is er bijvoorbeeld sprake van een extra chromosoom. Met toepassing van PGS kunnen deze embryo's eruit gefilterd worden en worden alleen embryo's met een normaal aantal chromosomen teruggeplaatst of ingevroren.
Verschillende onderzoeken hebben aangetoond dat gemiddeld, 50% van menselijke preimplantatie embryo's van IVF een afwijkend chromosomen aantal hebben. Het percentage wordt vooral beinvloed door de leeftijd van de vrouw. Chromosomale afwijkingen zijn vaak de oorzaak voor het niet goed innestelen van de IVF embryo. Bovendien zijn chromosomale afwijkingen ook verantwoordelijk voor ongeveer 70% van de vroege miskramen.
Het is tegenwoordig mogelijk om alle 23 chromosoomparen te beoordelen. In Memorial Atasehir worden de volgende technologien gebruikt voor de beoordeling van de normaliteit van alle 23 chromosomen.
Next Generation Sequencing (NGS) en Array Comparative Genomic Hybridization (aCGH)
NHS is een van de nieuwe technieken om de chromosomentelling van embryo's te beoordelen en wordt sinds 2015 op steeds grotere schaal toegepast. Deze technieken zijn zeer goed in het opsporen van gedeeltelijke genoommutatie (aneuploïdie) en kleine ongebalanceerde translocaties. Mozaïcisme kan worden ontdekt door toepassing van Next Generation Sequencing.
Verbeteringen in de embryo bioptie technologie
In Memorial Hospital wordt de techniek genaamd Trophectoderm biopsy gebruikt om in de blastocyst fase van de embryo (dag 5) ongeveer 5 cellen weg te nemen uit de embryo (die dan ongeveer 100 cellen telt). Dit beinvloedt de embryo verder niet. De cellen die worden weggehaald uit de embryo zitten in de trophectoderm (voorliggende cellen voor de placenta). de binnenste cellen (voorliggende cellens voor de foetus) worden niet gestoord tijdens de bioptie. Deze technologie heeft de zwangerschaps percentages aanzienlijk verbeterd bij IVF patienten.
Wanneer komt u in aanmerking voor PGS? Ongeveer 50% van alle spontane miskramen gebeuren door chromosomale afwijkingen. Ook zijn sommige geboorteafwijkingen te verklaren uit chromosomale afwijkingen, en de kans op het krijgen van een kind met een chromosomale afwijking wordt groter naarmate de leeftijd van de moeder hoger is. Stellen die een verhoogd risico hebben op aan afwijkend aantal chromosomen bij een embryo, zijn zeer geschikte kandidaten voor PGS. Dit betreft:
- gevallen waarbij de vrouw ouder is dan 35 jaar
- stellen die meerdere spontane miskramen hebben gehad
- stellen die meerdere onsuccesvolle IVF-behandelingen hebben gehad
- gevallen waarbij de man een lage sperma concentratie heeft
- stellen waarbij bij een eerdere zwangerschap chromosomale afwijkingen zijn geconstateerd
Potentiele candidaten voor PGS zijn vrouwen ouder dan 35 jaar die al in het IVF traject zitten en voldoende embryo's overhouden op dag 5. Het is alleen intreressant om PGS toe te passen als er meerdere embryo's in de blastocyst fase zitten. Maar PGS is ook interessant voor jongere vrouwen wanneer zij meerdere onsuccesvolle IVF-behandelingen hebben gehad. PGS kan wellicht een antwoord bieden waarom de embryo's niet innestelen bij sommige stellen.
Voordelen van PGS
Het meerdendeel van de abnormale embryo's zijn met een microscoop niet te onderscheiden van normale embryo's. Dit betekent dat een embryo niet kan worden beoordeeld op zichtbare kenmerken wanneer we zoeken naar chromosomale afwijkingen. Voor vrouwen ouder dan 35 is het risico op chromosomale afwijkingen significant groter dan bij jongere vrouwen. Het probleem van een hoger percentage abnormale embryo's bestaat ook bij vrouwen die meerdere miskramen hebben gehad, vrouwen die eerdere onsuccesvolle IVF/ICSI-pogingen hebben gehad, en mannen waarbij de sperma analyse ernstige afwijkingen vertoont.
De voornaamste voordelen van Preimplantation Genetic Screening zijn betere kansen op het implanteren van de embryo, minder kans op een miskraam, en een hogere kans op het krijgen van een gezonde baby. Bovendien kan door het toepassen van PGS sneller een zwangerschap bereikt worden, in vergelijking tot een gebruikelijke IVF -cyclus.
Effectiviteit van Preimplantation Genetic Screening
Als een embryo na het uitvoeren van de PGS test een normaal aantal chromosomen blijkt te bevatten, is de kans op zwangerschap meer dan 60% bij vrouwen jonger dan 40 jaar. Bij vrouwen ouder dan 40 jaar is de kans hoger dat er in verschillende pogingen geen enkele embryo een normaal aantal chromosomen heeft, maar wanneer er normale embryo's gevonden worden door toepassing van PGS, dan is de kans op zwangerschap ongeveer 50%. De percentages van embryo's met een normaal aantal chromosomen in verhouding tot leeftijd van de vrouw, is als volgt:
Leeftijd vrouw (in jaren) Percentage normale embryo's
30-34 60%
35-39 40%
40+ 20%
Deze bevindingen zijn gebaseerd op een grote schaal van data en biedt geen garantie dat er altijd normale embryo's uit de PGS test komen: in enkele gevallen kan de test ook uitwijzen dat geen enkele embryo een normaal aantal chromosomen bevat. In dat geval wordt de behandeling stopgezet en vindt er geen terugplaatsing plaats.
Kosten PGS
In de VS wordt PGS toegepast, en de kosten daar liggen erg hoog, tussen 4.000$ - 9000$ per cyclus, alleen voor de PGS. In slechts enkele Europese landen wordt PGS toegepast, waaronder Spanje. De kosten liggen echter enorm hoog voor deze technologie. In Turkije echter, betaalt u per embryo 325 euro voor de Preimplantation Genetic Screening middels de NGS methode. Mocht het zo zijn dat u op dag 5 heel veel blastocyst embryo's over heeft, dan kunnen we in overleg met u besluiten om in eerste instantie alleen de helft te testen met NGS. Als daar gezonde blastocysten tussen zitten, kunnen daar 1 of 2 van teruggeplaatst worden en de niet geteste blastocysten kunnen ingevroren worden.
Verschil tussen PGS en PGD
PGD is een afkorting voor preïmplantatie genetische diagnostiek. Dit is een methode waarmee de geboorte van kinderen met een ernstige genetische aandoening voorkomen kan worden. PGD wordt uitgevoerd bij paren die een sterk verhoogd risico hebben op het krijgen van een kind met een genetische aandoening, bijvoorbeeld een chromosoomafwijking, taaislijmziekte, hemofilie, de ziekte van Huntington of een ernstige spierziekte. Bij een PGD wordt een test ontwikkeld met ten minste het bloed van de man en de vrouw, waarmee de embryo's op dag 3 van de laboratorium fase getest worden op een erfelijk gendefect: vooraf is dus al bekend welk defect op welk chromosoom of gen gezocht wordt.
Bij PGS daarentegen wordt niet één bepaald gen of chromosoom gezocht, maar worden de chromosomen geteld in de cellen die op dag 5 uit het embryo zijn verkregen. Door middel van PGS kan het laboratorium een selectie maken van bevruchte embryo’s, niet alleen op basis van hun morfologie (de vorm en het aantal cellen), maar ook van hun chromosomale inhoud.